详细介绍
组蛋白修饰的类型
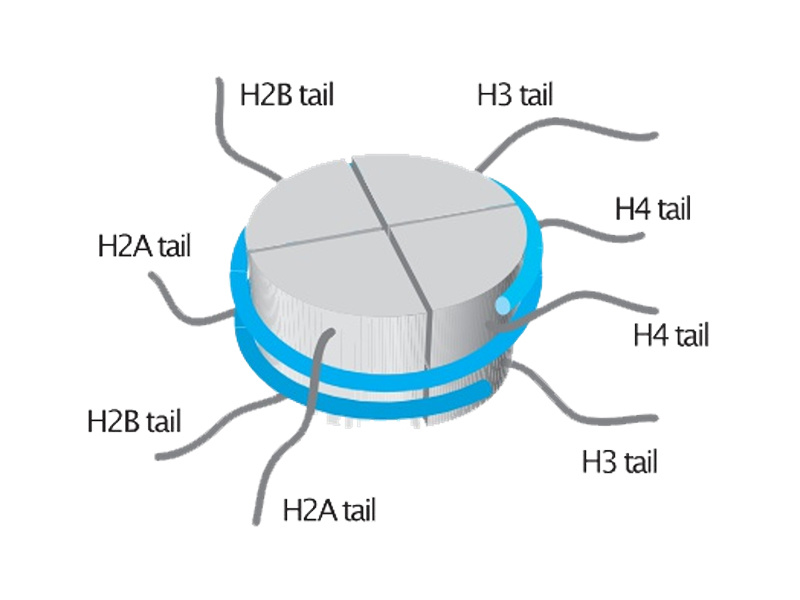
染色质结构、核小体定位和最终接近 DNA 进行的基因转录在很大程度上由组蛋白控制。每个核小体 由两个相同的亚基组成,每个亚基含有四个组蛋白:H2A、H2B、H3 和 H4。同时,H1 作为连接组蛋 白,起到稳定核小体间 DNA 的作用,但不属于核小体的组成部分。
组蛋白经过不同形式的翻译后修饰(PTM),致使其与 DNA 的相互作用受到影响。一些修饰破坏了组 蛋白-DNA 相互作用,导致核小体解旋。在这种开放的染色质构象(称为常染色质)中,DNA 可以与 转录复合物结合,随后基因激活。相反,加强组蛋白-DNA 相互作用的修饰会产生一种紧密排列的染色 质结构,称为异染色质。在这种紧凑的形式中,转录复合物无法接近 DNA,导致基因沉默。因此,染 色质重塑复合物对组蛋白的修饰改变了染色质结构和基因激活。
已发现的不同类型的组蛋白修饰至少有 9 种。乙酰化、甲基化、磷酸化和泛素化是大家最了解的,而 N-乙酰葡萄糖胺糖基化、瓜氨酸化、巴豆酰化和异构化最近才发现,还有待深入研究。每种修饰都是 通过一组特定的酶将修饰基团添加到组蛋白氨基酸残基上或从组蛋白氨基酸残基上去除的。
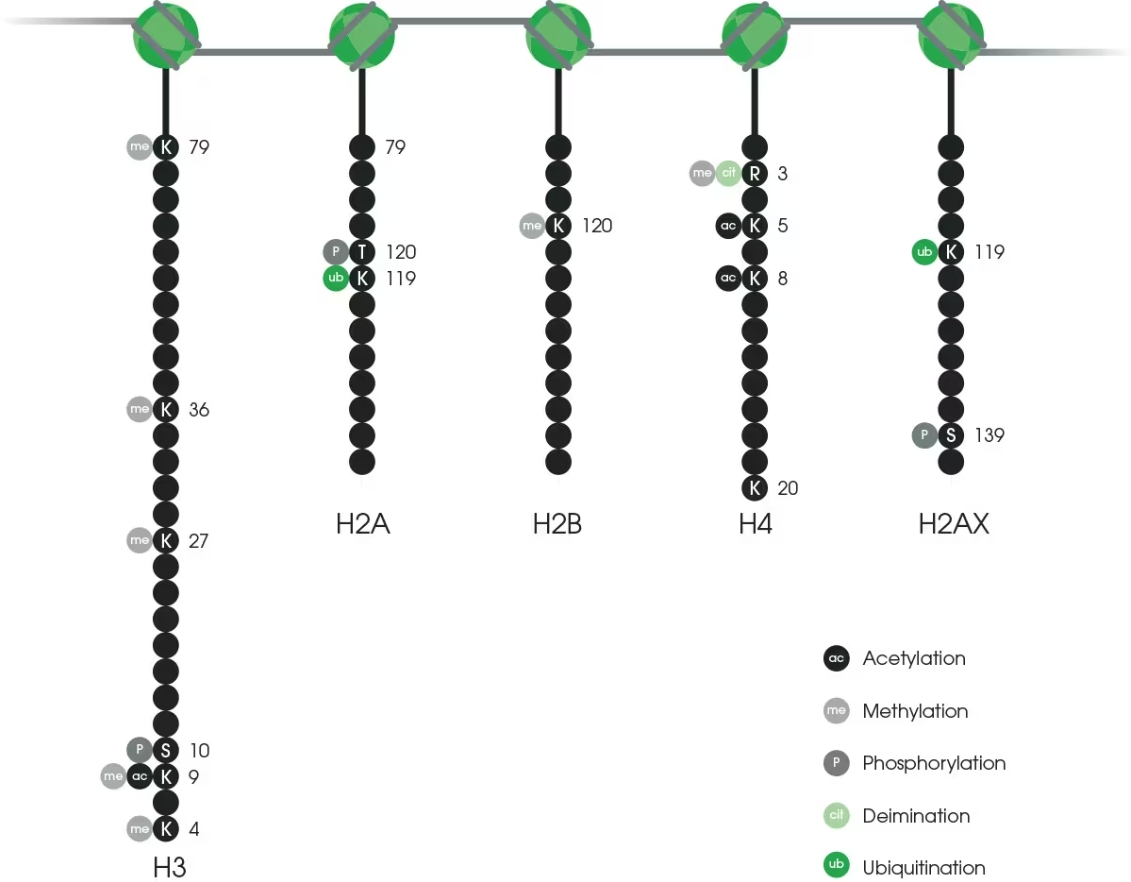
图1 最常见的组蛋白修饰
总之,这些组蛋白修饰组成了所谓的组蛋白密码,而组蛋白密码决定了局部基因组区域的转录状态。 检查特定区域或整个基因组的组蛋白修饰,可以揭示基因激活状态,启动子、增强子和其他基因调控 元件的位置。
组蛋白修饰详情
乙酰化
乙酰化是最早发现的影响转录调控的组蛋白修饰之一,因此目前研究的最多。乙酰化使 从核小体伸出 的 N-末端组蛋白尾部的赖氨酸残基带负电荷,这些负电荷会排斥带负电荷的 DNA,导致染色质结构 松弛。开放的染色质构象允许转录因子结合并显著增加基因表达 (Roth et al., 2001)。
组蛋白乙酰化参与细胞周期调控、细胞增殖和凋亡,并在调节细胞分化、DNA 复制和修复、核输入和 神经元抑制等多种细胞过程中发挥重要作用。组蛋白乙酰化的平衡失调与肿瘤发生和癌症进展有关。
酶调节
乙酰基被组蛋白乙酰转移酶 (HAT) 添加到组蛋白 H3 和 H4 的赖氨酸残基上,并被去乙酰化酶 (HDAC) 除去。组蛋白乙酰化主要靶向启动子区域,称为启动子局部乙酰化。例如,组蛋白 H3(H3K9ac 和 H3K27ac)上 K9 和 K27 的乙酰化通常与活性基因的增强子和启动子有关。转录基因中也发现了 低水平的整体乙酰化,但其功能尚不清楚。
甲基化
组蛋白 H3 和 H4 的赖氨酸或精氨酸残基被甲基化,对转录有不同的影响。精氨酸甲基化可以促进转 录激活 (Greer et al., 2012),而赖氨酸甲基化则同时涉足转录激活和抑制,具体取决于甲基化位点。这 种灵活性可以解释为甲基化不会改变组蛋白电荷,也不会直接影响组蛋白-DNA 相互作用,与乙酰化不同。
赖氨酸可以单甲基化、双甲基化或三甲基化,从而为每个甲基化位点提供进一步的功能多样性。例如, 组蛋白 H3 K4 (H3K4me1 和 H3K4me3)上的单甲基化和三甲基化都是活化标志物,但是也有着特殊 的细微差别:H3K4me1 通常会标记转录增强子,而 H3K4me3 则标记基因启动子。同时,K36 (H3K36me3) 的三甲基化是与基因转录区域相关的活化标志物。
相反,组蛋白 H3 K9 和 K27 (H3K9me3 和 H3K27me3) 上的三甲基化是具有独特功能的抑制信号: H3K27me3 是控制胚胎干细胞中发育调控因子(包括 Hox 和 Sox 基因)的启动子区域的一个临时信 号。同时,H3K9me3 是在具有串联重复结构的基因贫乏染色体区域形成异染色质的永久信号,如卫星 重复序列、端粒和近着丝粒区。它也标记反转录转座子和特定的锌指基因家族 (KRAB-ZFPs)。这两个 标记均在失活的 X 染色体上发现,其中,H3K27me3 位于基因间和沉默的编码区,H3K9me3 主要位 于活性基因的编码区。
酶调节
组蛋白甲基化是一种可以通过多次细胞分裂而仍然保持的稳定标记,多年来一直被认为不可逆。但是, 最新研究发现,它是一个主动调控和可逆的过程。
甲基化:组蛋白甲基转移酶 (HMTs)
- 赖氨酸
- 包含 SET 结构域(组蛋白尾部)
- 包含非 SET 结构域(组蛋白核心)
- 精氨酸
- PRMT(蛋白质精氨酸甲基转移酶)家族
去甲基化:组蛋白脱甲基酶类
- 赖氨酸
- KDM1/LSD1(赖氨酸特异性脱甲基酶 1)
- JmjC(包含 Jumonji 域)
- 精氨酸
- PAD4/PADI4
磷酸化
组蛋白磷酸化是细胞分裂、转录调控和 DNA 损伤修复过程中染色体浓缩的关键中间步骤 (Rossetto et al., 2012, Kschonsak et al., 2015)。与乙酰化和甲基化不同,组蛋白磷酸化建立了其他组蛋白修饰之间的 相互作用,并充当效应蛋白的平台,导致下游级联事件。
磷酸化发生在所有核心组蛋白上,并且对每一个核心组蛋白都有不同的作用。组蛋白 H3 在丝氨酸 10 和 28 上的磷酸化,以及组蛋白 H2A 在 T120 上的磷酸化参与了染色质致密化以及有丝分裂过程中 染色质结构和功能的调节。这些是细胞周期和细胞生长的重要标志,在真核生物中得以保留。S139 处 H2AX 的磷酸化(产生 γH2AX)作为 DNA 损伤修复蛋白的招募点 (Lowndes et al., 2005, Pinto et al., 2010),是 DNA 双链断裂后最早发生的事件之一。目前对 H2B 磷酸化的研究还不够深入,但发现 H2B 磷酸化可促进凋亡相关的染色质浓缩、DNA 断裂和细胞死亡 (Füllgrabe et al., 2010)。
泛素化
所有组蛋白核心蛋白都可以被泛素化,但 H2A 和 H2B 是最常见的,也是细胞核中泛素化程度最高的 两种蛋白 (Cao et al., 2012)。组蛋白泛素化在 DNA 损伤反应中起核心作用。
在 DNA 双链断裂位点发现了组蛋白 H2A、H2B 和 H2AX 的单泛素化。最常见的形式是 H2A 上 K119 和 H2B 上 K123(酵母)/K120(脊椎动物)的单泛素化。H2A 单泛素化与基因沉默有关,而 H2B 与转录激活有关。
多聚泛素化较少见,但在 DNA 修复中也很重要。H2A 和 H2AX 在 K63 上的多聚泛素化为 DNA 修 复蛋白(如 RAP80)提供了一个识别位点。
酶调节
与其他组蛋白修饰一样,H2A 和 H2B 的单泛素化具有可逆性,并受到组蛋白泛素连接酶和去泛素化 酶的严密调控。
单泛素化
- H2A:多梳蛋白家族
- H2B:Bre1(酵母)及其同系物 RNF20/RNF40(哺乳动物)
多聚泛素化
- H2A/H2AX K63:RNF8/RNF168
组蛋白修饰快速参考指南
最常见的组蛋白修饰及发现位置:
组蛋白修饰 功能 位点
H3K4me1 活化 增强子
H3K4me3 活化 启动子
H3K36me3 活化 基因体
H3K79me2 活化 基因体
H3K9Ac 活化 增强子、启动子
H3K27Ac 活化 增强子、启动子
H4K16Ac 活化 重复序列
H3K27me3 阻遏 启动子,基因富集区域
H3K9me3 阻遏 卫星重复序列、端粒、近着丝粒区
γH2A.X DNA 复制 DNA 双链断裂
H3S10P DNA 复制 有丝分裂染色体
通过 ChIP 研究组蛋白修饰
ChIP 使用抗体来分离蛋白质或目标修饰,以及它所结合的 DNA(图 5)。然后对 DNA 进行测序,并 将其定位到基因组,以确定蛋白质或修饰的位置和丰度。
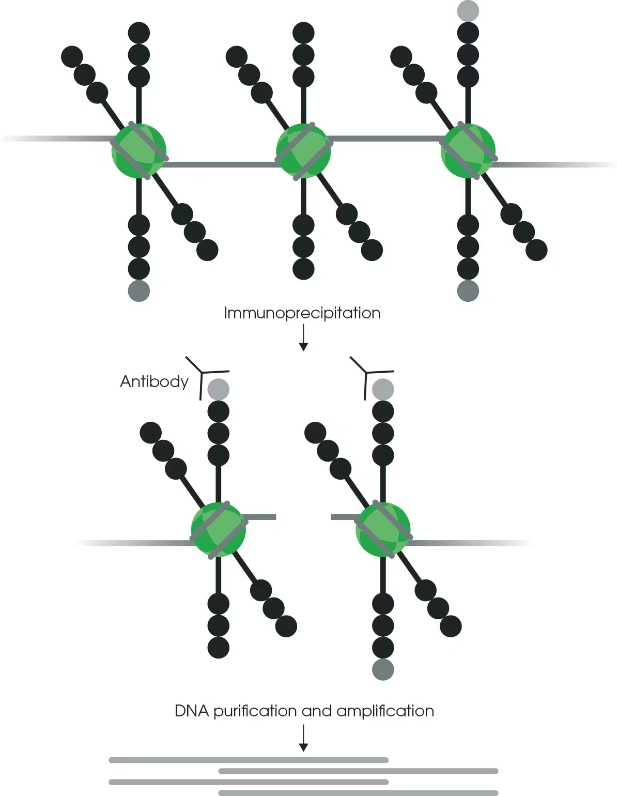
图 2:组蛋白修饰 ChIP。
抗体直接结合到修饰的组蛋白尾部。免疫沉淀和 DNA 纯化可以分离和鉴定修饰所占据的基 因组区域。
在 ChIP 实验中利用靶向特定组蛋白和组蛋白修饰的抗体可以揭示
- 高级染色质结构的特定位置,例如 H3K9me3 标记异染色质和卫星重复序列
- 活跃或沉默基因和遗传程序的特定位置,例如 AH3K9ac 标记基因激活
- 诸如启动子和增强子等遗传元件的特定位置,例如基因富集区域的 H3K27me3 标记启动子、 H3K4me1 标记活性增强子
如果知晓组蛋白修饰的功能,ChIP 就可以识别具有这种组蛋白修饰标记的特定基因和区域,及其在整 个基因组中的对应功能。然后可以进一步检测这些基因和区域在生物学过程中的作用。例如,针对 H3K4me1,使用 ChIP 可以揭示整个基因组中活性增强子的位置和序列,并指明目的基因和遗传程序。
或者,如果不知道组蛋白修饰的功能,ChIP 可以识别具有这一特定修饰的序列、基因和位置,然后利 用这些信息来推断修饰的功能。这种技术是解码许多组蛋白密码的关键,并且在探究新发现的修饰(如 泛素化)和其他新标记的功能方面也具备一定的价值。
组蛋白修饰酶:writers 和 erasers
组蛋白修饰是通过特定的酶以动态方式从组蛋白中添加和去除的(表 1)。这些 writers 和 erasers 之间的平衡决定了哪些标记存在于组蛋白上,以及处于什么水平,最终控制特定的遗传程序及其编排的细胞 过程处于开启还是关闭状态。
表 1:组蛋白 writers 和 erasers 的主要类别。
|
修饰 |
Writers |
Erasers |
|
乙酰化 |
组蛋白乙酰转移酶 (HATs) |
组蛋白去乙酰化酶 (HDAC) |
|
甲基化 |
组蛋白甲基转移酶(HMTs/KMTs)和蛋白精氨酸甲基转移酶 (PRMTs) |
赖氨酸去甲基酶 (KDMs) |
|
磷酸化 |
激酶类 |
磷酸酶类 |
识别修饰途径和起作用的特定 writers 和 erasers 可以揭示 。
- 更深层次的相关细胞通路、遗传程序和生理效应研究。例如,组蛋白去乙酰化酶 (HDACs) 激活免 疫发育通路,而组蛋白乙酰转移酶 (HATs) 在分化和增殖中发挥关键作用。
- 由于 writers 和 erasers 失衡所导致的遗传程序和相应的疾病过程改变。表征这些失衡和涉及的特定 酶可以为为人们了解从癌症到自身免疫性疾病的病理学提供重要见解。
- 新的药物靶点和治疗策略。一旦发现失衡,就可以开发药物来影响这些酶的活性并纠正失衡,为 医学上至今难以攻克的疾病提供新的治疗策略。例如,许多 HDAC 抑制剂正在开发中,作为对抗 癌症和炎症性疾病(如关节炎和 I 型糖尿病)的新型药物。
对于药物开发活动,根据对 writers 和 erasers 活性的影响,很容易筛选到相应的化合物。
表征组蛋白甲基化通路
一般来说,开发组蛋白甲基转移酶 (HMT) 检测试剂盒充满挑战;大多数检测试剂盒存在几个缺点,原 因出在检测试剂盒的设计上。典型 HMT 检测试剂盒用 3H-SAM 作甲基供体,并将 S-腺苷高半胱氨 酸 (SAH) 测定为甲基化反应的一般副产物。但是,这需要
- 处理放射性物质
- 较高的灵敏度,以克服甲基供体 SAM 的低 kcat(转化数通常 < 1 min-1)和 Km 值
- 预先纯化酶/蛋白复合物,以评估特定 HMTs 的活性
Abcam HMT 活性检测试剂盒克服了这些困难,采用检测特定甲基化产物的抗体来评估特定 HMT 的 活性,可确保:
- 比色或荧光检测简便,无放射性
- 与核提取物或纯化蛋白的相容性(检测试剂盒对目标修饰具有特异性)
- 3 小时内即可提供数据
表征去甲基酶活性
组蛋白去甲基化酶活性检测试剂盒通常测定甲醛(去甲基作用的副产物)的形成。因此,易受洗涤剂、 巯基和一系列离子的干扰。与甲基化检测试剂盒类似,这些检测试剂盒对任何去甲基化酶都没有特异性,只能用纯化的蛋白进行检测。
Abcam 的组蛋白去甲基化酶检测试剂盒通过直接测定去甲基化产物的形成来规避这些问题,可确保:
- 灵敏度比基于甲醛的检测试剂盒更高(20 - 1,000 倍)
- 无硫醇、洗涤剂或离子干扰的更准确的数据
- 与核提取物或纯化蛋白的相容性(得益于该检测试剂盒对目标修饰的特异性)
- 测定广泛物种(包括哺乳动物细胞/组织、植物和细菌)的去甲基化酶活性
- 具有简单比色或荧光读数的快速微孔板版本
- 3 小时内即可提供数据
表征组蛋白乙酰化通路
Abcam 提供可分析总体活性以及 H4 特异性的 HAT 活性的试剂盒。这些检测试剂盒可以检测 HAT 催化乙酰基从乙酰辅酶 a 供体转移到组蛋白肽的过程,该过程会生成乙酰化肽和 CoA-SH。然后通过 比色法或荧光法测定 CoA-SH 副产物:
- 比色法 - CoA-SH 作为生成 NADH 的必需辅酶,与可溶性四唑染料反应生成可通过分光光度法 检测的产物。比色法是动力学研究的理想选择,支持连续检测。
- 荧光法 - CoA-SH 与显色剂和探针反应生成可通过荧光检测的产物。
表征组蛋白去乙酰化酶活性
根据功能和 DNA 序列相似性,HDAC 蛋白可分为四大类(I 类、IIA 类、IIB 类、III 类、IV 类)。 I 类、IIA 类和 IIB 类被视为“经典”HDAC,其活性被曲古抑菌素 A (TSA) 抑制,而 III 类是 NAD + 依赖性蛋白家族 (sirtuins-SIRTs),不受 TSA 影响。由于 IV 类仅与其他类存在 DNA 序列相似性, 因此被单独视为非典型类。
这些类别中的每一类都与不同的细胞程序相关,可以用不同的荧光法进行单独测定。例如,SIRT 通常 与癌症和神经系统疾病相关。检测 SIRT 活性,或发现影响 SIRT 活性的药物,可能有望找到这些疾 病的新型诊断或治疗策略。
荧光法使用的是乙酰化肽底物,该底物的氨基端和羧基端有荧光基团和淬灭基团。底物一旦去乙酰化, 就会被肽酶裂解,将荧光基团从淬灭剂中释放出来。随后荧光团荧光强度的增加与去乙酰化酶活性成正比。
抑制 writers 和 erasers
先用小分子抑制这些修饰酶,再评估下游后果,进而探测组蛋白修饰的参与和生物学功能,这非常有 用。因此,writers 和 erasers 的抑制剂是理解表观遗传修饰通路作用的关键工具。在学术和行业临床前 研究的背景下,这些抑制剂对“可成药”靶标的验证也至关重要。
组蛋白修饰 readers/translators
组蛋白通过直接修饰(例如,乙酰基团排斥带负电荷的 DNA,以产生开放染色质构象)或称为效应物 的蛋白质接头来调节染色质的物理性质及其相应的转录状态。效应蛋白识别并结合特定的表观遗传标 记,随后,招募分子复合物来改变染色质结构。这些表观遗传 readers 通过翻译组蛋白密码来决定组蛋 白修饰的功能结果。
效应结构域识别特异性组蛋白修饰
效应蛋白通过效应结构域识别并结合组蛋白修饰标记,称为模块(表 2)。
表 2:通过模块或组蛋白结合蛋白识别组蛋白标记。
|
组蛋白结合或效应模块 |
已知组蛋白标记 |
|
染色质域 |
H3K4me2/3、H3K9me2/3、H3K27me2/3 |
|
Tudor 结构域 |
H3K4me3、H4K20me2 |
|
MBT 结构域 |
H3K4me1、H4K20me1/2、H1K26me1 |
|
WD40 重复序列蛋白 |
R2/H3K4me2 |
|
溴结构域 |
Kac |
|
PHD 结构域 |
H3K4、H3K4me3、H3K9me3、K36me3 |
|
14-3-3 |
H3S10ph |
|
BRCT 结构域 |
H2A.XS139 |
这些模块通过模块结合口袋外围的氨基酸来识别特定的组蛋白修饰。同时,该结合口袋外的残基(特别是 N+2 和 N-2 位置上的残基)决定了对被修饰的组蛋白和氨基酸残基(即 H3K4 与 H4K20)的特异性。
结合口袋内外残基的细小差异可以识别相似的表观遗传标记。例如,效应蛋白可区分单甲基化、双甲基化或三甲基化状态,但甲基结合模块结构略有不同。举个例子,tudor 结构域可能只结合二甲基化或三甲基化的赖氨酸,而 PHD 手指模块可能同时结合两者,或者只结合未修饰的赖氨酸 (Ruthenburg et al., 2007)。
多价性使组蛋白密码复杂化
同一蛋白和/或蛋白复合物中通常存在多个组蛋白结合模块,能够识别特异性的组蛋白修饰结合位点。这使得组蛋白密码变得更加复杂化,其中组蛋白修饰之间相互作用而不是单独地发挥作用。
组蛋白修饰的多价结合对于识别具有复合特异性和增强亲和力的离散标记模式,同时实现多样且精确的下游作用非常重要。例如,单个表观遗传标记(如 H3K4me3)可能在一个环境中激活基因转录,但在另一个环境中对其进行抑制,具体取决于周围的标记。表 3 给出了不同组蛋白修饰组合的一些功能性关联的例子 (Ruthenburg et al., 2007)。
表 3:共存组蛋白和 DNA 修饰的功能关联
|
组蛋白标记 |
染色质状态 |
|
H3K4me2/3 + H4K16ac |
转录活性同源异型基因 |
|
H3K4me2/3 + H3K9/14/18/23ac |
转录活性染色质 |
|
H3S10ph + H3K14ac |
有丝分裂刺激的转录 |
|
H3K4me3 + H3K27me3 |
二价结构域 |
|
H3K9me3 + H3K27me3 + 5mC |
沉默位点 |
|
H3K27me3 + H2AK119ub1 |
沉默同源异型基因 |
|
H3K9me3 + H4K20me3 + 5mC |
异染色质 |
|
H3K9me2/3 + H4K20me1+ H4K27me3 + 5mC |
失活 X 染色体 |
一个蛋白或复合物中的多个效应模块可能在相同或整个组蛋白和/或核小体上与组蛋白修饰相互作用。这些相互作用可分为:
核小体内相互作用:与相同核小体结合
- 顺式组蛋白:与相同组蛋白尾部结合
- 反式组蛋白:与不同组蛋白尾部结合
核小体间相互作用:与不同核小体结合
- 相邻桥接:与相邻核小体桥接
-
不连续桥接:与非相邻核小体桥接
| 产品编号 | 产品名称 | 规格 | 纯度 | 价格 |
| H1300 | H2A | 50 μg | ≥95% | ¥390 |
| H1301 | H2A-Y57ph | 50 μg | ≥95% | ¥3,728 |
| H1302 | H2A-S96ph | 50 μg | ≥95% | ¥3,728 |
| H1401 | H2A-K13Ub | 50 μg | ≥95% | ¥4,131 |
| H1402 | H2A-K15Ub | 50 μg | ≥95% | ¥4,131 |
| H1403 | H2A-K119Ub | 50 μg | ≥95% | ¥4,131 |
| H1404 | H2A.ZK121Ub | 50 μg | ≥95% | ¥4,131 |
| H2300 | H2B | 50 μg | ≥95% | ¥390 |
| H2301 | H2B-S14ph | 50 μg | ≥95% | ¥3,728 |
| H2401 | H2B-K34Ub | 50 μg | ≥95% | ¥4,128 |
| H2402 | H2B-K120Ub | 50 μg | ≥95% | ¥4,128 |
| H3100 | H3 | 50 μg | ≥95% | ¥390 |
| H3101 | H3-K4me1 | 50 μg | ≥95% | ¥4,929 |
| H3102 | H3-K4me2 | 50 μg | ≥95% | ¥5,323 |
| H3103 | H3-K4me3 | 50 μg | ≥95% | ¥4,929 |
| H3104 | H3-K9me1 | 50 μg | ≥95% | ¥4,929 |
| H3105 | H3-K9me2 | 50 μg | ≥95% | ¥5,323 |
| H3106 | H3-K9me3 | 50 μg | ≥95% | ¥4,929 |
| H3107 | H3-K27me1 | 50 μg | ≥95% | ¥4,929 |
| H3108 | H3-K27me2 | 50 μg | ≥95% | ¥5,323 |
| H3109 | H3-K27me3 | 50 μg | ≥95% | ¥4,929 |
| H3110 | H3-K36me1 | 50 μg | ≥95% | ¥4,929 |
| H3111 | H3-K36me2 | 50 μg | ≥95% | ¥5,323 |
| H3112 | H3-K36me3 | 50 μg | ≥95% | ¥4,929 |
| H3113 | H3-R42me2a | 50 μg | ≥95% | ¥5,760 |
| H3114 | H3-K79me2 | 50 μg | ≥95% | ¥6,407 |
| H3202 | H3-K18ac | 50 μg | ≥95% | ¥4,929 |
| H3201 | H3-K56ac | 50 μg | ≥95% | ¥5,323 |
| H3203 | H3-K64ac | 50 μg | ≥95% | ¥5,323 |
| H3204 | H3-K122ac | 50 μg | ≥95% | ¥4,929 |
| H3301 | H3-S10ph | 50 μg | ≥95% | ¥5,175 |
| H3302 | H3-T118ph | 50 μg | ≥95% | ¥5,175 |
| H4100 | H4 | 50 μg | ≥95% | ¥390 |
| H4101 | H4-K20me2 | 50 μg | ≥95% | ¥4,484 |
| H4201 | H4-K8ac | 50 μg | ≥95% | ¥4,322 |
| H4202 | H4-K12ac | 50 μg | ≥95% | ¥4,322 |
| H4203 | H4-K16ac | 50 μg | ≥95% | ¥4,322 |
| H4204 | H4-K20ac | 50 μg | ≥95% | ¥4,322 |
| H4205 | H4-K5ac | 50 μg | ≥95% | ¥4,322 |
| C16314 | CENPA-S17ph | 50 μg | ≥95% | ¥4,878 |
| C16368 | CENPA-S68ph | 50 μg | ≥95% | ¥4,878 |



